摘要:USP18介導(dǎo)的去ISG化(deISGylation)建立的動態(tài)平衡對結(jié)核病的發(fā)生、發(fā)展和轉(zhuǎn)歸有重要影響�。
干擾素誘導(dǎo)基因15 (interferon-stimulated gene 15��,isg15)的表達(dá)受Ⅰ型干擾素誘導(dǎo)�,該基因編碼的蛋白ISG15可以分別通過E1、E2和E3酶的作用共價修飾靶蛋白��,此過程被稱為ISG化(ISGylation)��。宿主蛋白的ISG化廣泛參與天然免疫例如宿主的抗病毒過程�����。泛素特異性蛋白酶18 (ubiquitin-specific protease 18�,USP18)作為一種去泛素化酶(deubiquitinase�,DUB)可以去除靶蛋白偶聯(lián)的 ISG15�,并通過抑制Ⅰ型干擾素信號通路來抑制宿主的免疫應(yīng)答��。
泛素特異性蛋白酶18 (ubiquitin-specific protease 18
�����,USP18)和干擾素誘導(dǎo)基因15 (interferonstimulated gene 15����,isg15)介導(dǎo)的ISG化修飾是機體參與抗病原微生物感染的重要組分。越來越多的研究發(fā)現(xiàn)����,靶向ISG15和USP18及其底物的蛋白質(zhì)翻譯后修飾有望開發(fā)成為新型抗感染治療的策略之一。
USP18
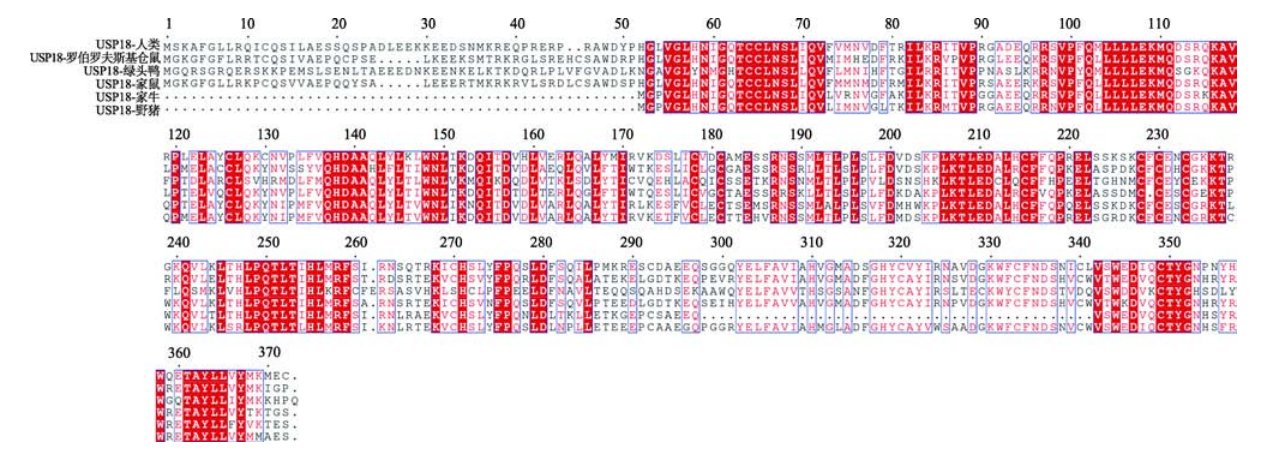
是一個大小約 43 kDa的特異性蛋白酶�,ISG15和USP18均可被干擾素(interferon,IFN)誘導(dǎo)����。通過比較人類(Homo sapiens)、家鼠(Mus musculus)��、家牛(Bos taurus)�����、野豬(Sus scrofa)、羅伯羅夫斯基倉鼠(Phodopus roborovskii)�、綠頭鴨(Anas platyrhynchos)等物種中USP18的氨基酸序列,發(fā)現(xiàn)不同物種中的 USP18 具有高度的同源性��。USP18在不同物種中都含有高度保守的序列����,該保守序列包括半胱氨酸殘基和組氨酸殘基位于 USP18 的活性中心,這也是 USP家族蛋白酶所特有的結(jié)構(gòu)��。
USP18蛋白在不同物種中保守
ISG15
能夠參與并激活多種信號通路���,發(fā)揮抗病毒免疫的功能���,與之相反,USP18會限制NF-κB��、JNK和NFAT等通路的激活����,負(fù)調(diào)節(jié)炎癥反應(yīng),調(diào)節(jié)T淋巴細(xì)胞和輔助性T細(xì)胞的活化��。USP18在Ⅰ型IFN中的作用下依賴于α/β干擾素受體2 (interferon alpha/beta receptor 2����,IFNAR2),并負(fù)調(diào)控Ⅰ型IFN信號通路�。USP18可以切割ISG15與靶蛋白之間的異肽鍵,還
能在結(jié)合后立即切割ISG15
的LRLRGG序列��,在由ISG15前體加工為成熟的ISG15過程中發(fā)揮重要作用���。鑒于ISG15和USP18在介導(dǎo)宿主蛋白泛素化和去泛素化以及免疫應(yīng)答中的重要作用�����,來自西南大學(xué)生命科學(xué)學(xué)院現(xiàn)代生物醫(yī)藥研究所的研究團(tuán)隊對ISG15
和USP18及其突變體在結(jié)核分枝桿菌(Mycobacterium tuberculosis���,Mtb)等感染免疫應(yīng)答中的作用機制進(jìn)行解讀,并探討了其作為治療靶點的潛力�。
ISG15特異性蛋白酶——USP18
蛋白去泛素化是由一組去泛素酶(deubiquitinase
,DUB)介導(dǎo)的泛素化的反向過程���。DUB家族有90多個成員��。泛素特異性蛋白酶USP18和USP20屬于DUBs的USP亞家族����,并介導(dǎo)靶蛋白的去泛素化。USP20靶向多種蛋白質(zhì)底物��,包括HIF1α����、β-腎上腺素能受體、TNF受體關(guān)聯(lián)因子6(TNF receptor associated factor 6�,TRAF6)和Claspin,通過去泛素化調(diào)節(jié)Toll樣受體4(toll-like receptor 4�����,TLR4)信號轉(zhuǎn)導(dǎo)和DNA損傷修復(fù)���。USP18最初被鑒定為DUB���,后來被發(fā)現(xiàn)也具有去ISG化酶活性,因為小鼠中USP18缺失或非活性突變體usp18C61A會導(dǎo)致高水平的ISG化���。此外�,USP18在ISG15前體加工產(chǎn)生成熟的 ISG15 分子過程中也發(fā)揮作用�����,但在 USP18缺陷小鼠中,ISG15前體也能被加工成其成熟形式�����,重組ISG15前體可以被II型肺泡上皮細(xì)胞A549的一種大小100 kDa的酶正確加工�����,且該酶是酵母泛素特異性肽酶 1(ubiquitin-specific protease�����,USP1)同源物�����,活性不受I型IFN刺激的影響�����。這提示除USP18 之外����,還有其他 ISG15 特異性蛋白酶。
一些E2
和E3酶在ISG15化和泛素化過程中的功能具有重疊�����,也意味著存在可以作為ISG15 特異性蛋白酶的多功能 DUB�,包括 USP2、USP5�、USP13 和 USP14 在內(nèi)的幾種 DUB 都被認(rèn)為是ISG15 特異性蛋白酶的候選物。但是��,小鼠中USP18基因的缺失會導(dǎo)致組織中ISG15 結(jié)合物大量增加����,而不會影響泛素結(jié)合物的水平,這表明USP18是ISG15特異性蛋白酶�����,可將ISG15從靶蛋白上去除����。
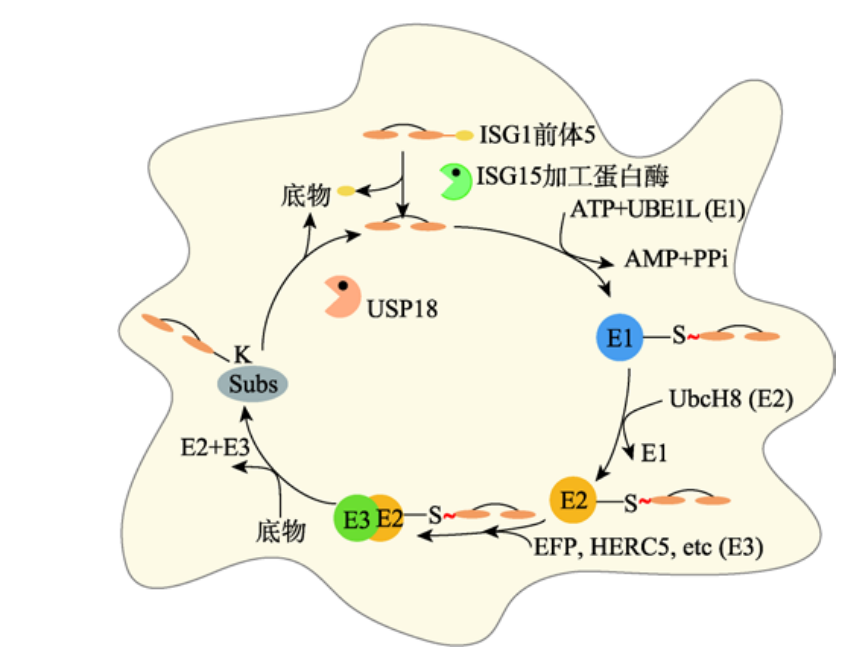
ISGylation 過程
ISG15
前體經(jīng)ISG15加工酶變成ISG15,分別與E1�、E2、E3泛素酶結(jié)合����,將ISG15結(jié)合在靶蛋白上���,USP18能夠從靶蛋白上去除ISG15,發(fā)揮去ISG化功能�。
USP18
的表達(dá)主要受I型IFN誘導(dǎo),而這種誘導(dǎo)需要通過JAK/STAT信號通路的作用��。干擾素
β (interferon-beta����,IFN-β)比干擾素 α (interferon-alpha���,IFN-α)和雙鏈 RNA (double strand RNA����,dsRNA)誘導(dǎo)USP18的作用更強�,但干擾素γ (interferon-gamma,IFN-γ)幾乎沒有誘導(dǎo)作用�����。USP18
也可被脂多糖(lipopolysaccharide��,LPS)誘導(dǎo)。干擾素調(diào)節(jié)因子2(interferon regulatory factor 2��,IRF2)和干擾素調(diào)節(jié)因子3 (interferon regulatory factor 3����,IRF3)都是LPS應(yīng)答所必需的,LPS通過IRF3上調(diào)USP18��,而IRF2可將其降至基礎(chǔ)水平�����。在各種造血細(xì)胞系中��,單核
細(xì)胞和巨噬細(xì)胞系能夠高水平表達(dá)USP18
��。Skp2 (S-phase kinase associated protein 2)是S期激酶相關(guān)蛋白����,屬于F-box蛋白家族,在蛋白泛素化降解過程中可作為 Skp1-Cul1-F-box(SCF)蛋白復(fù)合物的重要成分識別底物蛋白��,通過降解細(xì)胞周期調(diào)節(jié)蛋白而調(diào)控細(xì)胞周期��。USP18 是Skp2的底物��,Skp2促進(jìn)USP18的泛素化和隨后的蛋白酶體降解。這表明SCF-Skp2可能通過控制USP18的穩(wěn)定性���,調(diào)節(jié)I型IFN信號轉(zhuǎn)導(dǎo)����。然而���,有大量基因例如急性髓系白血病(acute myeloid leukemia����,AML)融合基因AML1-ETO誘導(dǎo)USP18上調(diào)的機制尚待研究�。
USP18負(fù)調(diào)節(jié)先天免疫反應(yīng)
ISG15
和USP18在宿主對病毒感染的反應(yīng)中起著重要作用。在I型IFN處理后�����,與野生型細(xì)胞相比����,usp18C61A細(xì)胞對B型流感病毒感染有更強的抵抗力�����,而病毒在isg15缺失的 usp18C61A 細(xì)胞中可完全恢復(fù)復(fù)制能力。除了其酶功能外�,USP18還負(fù)調(diào)控I型IFN信號轉(zhuǎn)導(dǎo),與Janus激酶(janus kinase����,JAK)競爭結(jié)合IFNAR2。因此�,與野生型細(xì)胞相比,用I型IFN 處理usp18?/?細(xì)胞導(dǎo)致信號轉(zhuǎn)導(dǎo)轉(zhuǎn)錄激活因子 (signal transducers and activators of transcription 1����,STAT1)磷酸化增加且持續(xù)時間延長,增強ISG化��,并促進(jìn)細(xì)胞凋亡�����。這與抑制USP18可增強HepG2.2.15細(xì)胞中IFN-α 的抗乙型肝炎病毒(hepatitis B virus���,HBV)活性這一結(jié)論相吻合���。
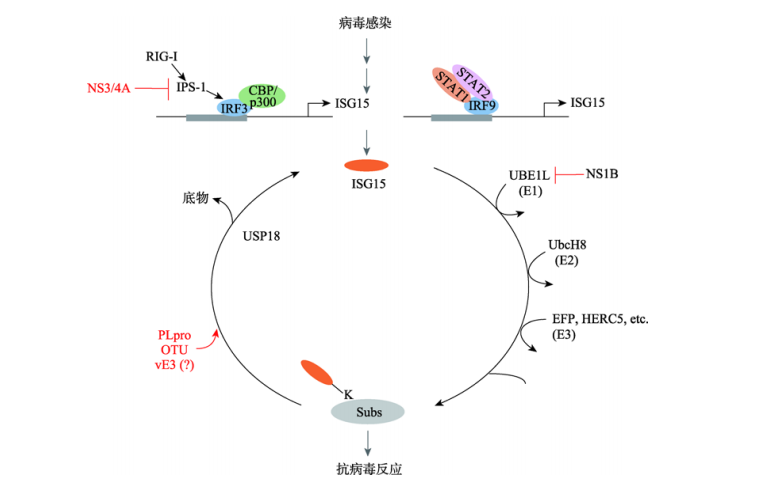
ISG15的類泛素化修飾介導(dǎo)抗病毒免疫
模式識別受體如RIG-I
在先天免疫細(xì)胞中表達(dá),招募接頭分子IPS-1�,進(jìn)而觸發(fā)MAVS-TBK1-IRF3 通路等信號通路的激活��,ISG15能夠靶向并參與修飾一系列重要的抗病毒蛋白���,如STAT1、IRF3����、RIG-I
等,病毒感染過程中ISG15介導(dǎo)的ISGylation以及與底物的結(jié)合能夠使宿主發(fā)揮抗病毒反應(yīng)���,同時USP18將負(fù)調(diào)控某些抗病毒蛋白的表達(dá)�。
USP18先天缺失與相關(guān)疾病
USP18
基因的缺失使細(xì)胞內(nèi)的IFN水平失調(diào)��,一方面可能會導(dǎo)致個體出現(xiàn)先天致死���,但另一方面也能夠增強癌癥患者或病毒感染患者的免疫應(yīng)答����,促進(jìn)癌癥治療和病毒清除����。
ISG15
缺失的個體易患孟德爾遺傳易感性的分枝桿菌病(mendelian susceptibility to mycobacterial disease
����,MSMD)�����,這是因為缺失ISG15會觸發(fā)T細(xì)胞和自然殺傷細(xì)胞(natural killer cell��,NK)產(chǎn)生過量的IFN-γ����。USP18小鼠更容易感染Mtb����,肺和脾臟中的細(xì)菌數(shù)量增加,
炎性細(xì)胞因子升高�����,肺部病變更嚴(yán)重�。
蛋白質(zhì)泛素化修飾是感染免疫的重點研究對象之一,去泛素酶USP18
是維持細(xì)胞中ISG15共價修飾蛋白質(zhì)的動態(tài)平衡和功能的關(guān)鍵��,在DNA/RNA病毒感染期間調(diào)節(jié)病毒復(fù)制�、聚集以及對宿主的易感性。HBV等病原可以逃避宿主模式識別受體的識別��、抑制下游信號轉(zhuǎn)導(dǎo),調(diào)控宿主 USP18 等去泛素化酶活性而干擾IFN信號轉(zhuǎn)導(dǎo)��,最后逃避免疫清除����。
因此針對DUBs
尤其是USP18在患者中的異常表達(dá)及其調(diào)控因子研發(fā)新的靶向藥物,將有助于開發(fā)新的抗感染工具����。
參考文獻(xiàn)
-
Reyes-Turcu FE, Ventii KH, Wilkinson KD. Regulation and cellular roles of ubiquitin-specific deubiquitinating enzymes. Annu Rev Biochem, 2009, 78: 363–397.
-
Yasunaga J, Lin FC, Lu XB, Jeang KT. Ubiquitin-specific peptidase 20 targets TRAF6 and human T cell leukemia virus type 1 tax to negatively regulate NF-kappaB signaling. J Virol, 2011, 85(13): 6212–6219.
-
Huijser E, Bodewes ILA, Lourens MS, van HeldenMeeuwsen CG, van den Bosch TPP, Grashof DGB, van de Werken HJG, Lopes AP, van Roon JAG, van Daele PLA,Brkic Z, Dik WA, Versnel MA. Hyperresponsive cytosolic DNA-sensing pathway in monocytes from primary Sj?gren's syndrome. Rheumatology (Oxford), 2022, 61(8): 3491–3496.
-
Anne-Boland-Auge, Deleuze JF, El-Chehadeh S, Anheim M, de Saint-Martin A, Pellegrini S, Marsh JA, Crow YJ, El-Daher MT. Type I interferonopathy due to a homozygous loss-of-inhibitory function mutation in STAT2. J Clin Immunol, 2023, 43(4): 808–818.
-
Qi’ao Zhang, Zilu Wang, Peibo Li, Jianping Xie.USP18-mediated protein deISGylation and its role in tuberculosis and other infectious diseases.Hereditas (Beijing) 2023, 45(11): 998―1006.