相比傳統小分子藥物�����,重組蛋白藥物具有高活性���、高特異性和低毒性等多種獨特優(yōu)勢��,但囿于機體內蛋白水解�����、腎臟消除�、肝臟代謝以及免疫清除等影響���,往往導致重組蛋白藥物的體內半衰期短�����,使用受限����。
當藥物進(jìn)入系統時(shí)����,由各種酶引起的代謝�,尤其是多種形式的蛋白水解酶的作用����,可導致藥物降解為小分子肽或者氨基酸����。這類(lèi)酶廣泛存在于胃�����、腸道����,其分布具有細胞組織的特異性�����。非蛋白酶因素的影響來(lái)源于蛋白質(zhì)物理或化學(xué)上的變化�。物理變化包括聚合����、沉淀�����;化學(xué)變化包括氨基酸殘基的修飾�,主要有氧化作用���、還原作用���、脫酰胺反應��、水解反應��、β消除��、二硫化物交換等幾種反應�,并且蛋白質(zhì)在構建中的穩定性和免疫原性以及導致蛋白質(zhì)化學(xué)結構錯誤變化的環(huán)境條件也被認為是影響蛋白質(zhì)代謝穩定性的主要因素�����。較大的多肽常通過(guò)受體介導的方式來(lái)清除���,有不少例子顯示�,受體介導的清除可能是一種主要的清除機制�����。
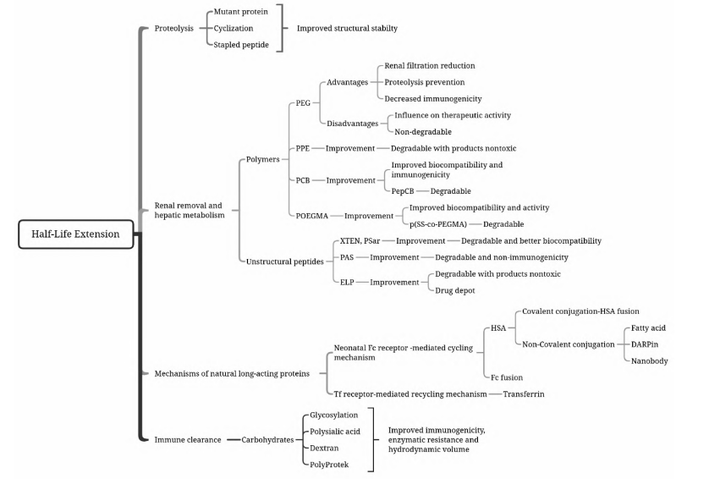
基于以上的清除機制����,延長(cháng)蛋白半衰期的策略主要分為保護酶解識別位點(diǎn)的結構改造策略���、改善蛋白理化性質(zhì)的天然或人工多聚物修飾策略以及降低免疫原性的碳水化合物修飾策略等�����。
Half-life extension strategies for therapeutic proteins and peptides
普健生物擁有專(zhuān)業(yè)的技術(shù)團隊����,在蛋白表達領(lǐng)域有著(zhù)15年的經(jīng)驗���,近20000+重組蛋白表達與純化經(jīng)驗�。為您提供六種高效蛋白表達系統:大腸桿菌表達系統��,枯草芽孢桿菌表達系統�����,酵母表達系統���,昆蟲(chóng)表達系統�,哺乳表達系統�����,二硫鍵活性原核表達系統���。普健生物專(zhuān)注于重組蛋白的表達�����,蛋白可溶性表達成功率在90%以上��。如果您有高效長(cháng)效蛋白表達需求����,歡迎聯(lián)系027-87001869與我們的專(zhuān)員進(jìn)行溝通�!
重組蛋白藥物的發(fā)展趨勢有以下兩個(gè)特點(diǎn):
第一�����,哺乳動(dòng)物細胞作為表達體系的比例增加�。原因在于�,原核表達系統(如大腸桿菌E. coli)����,適合分子量較小��、不需要翻譯后修飾的非糖基化蛋白(如胰島素��、生長(cháng)激素�����、干擾素和白細胞介素等)��;而哺乳動(dòng)物細胞表達系統可進(jìn)行復雜的翻譯后修飾(如蛋白質(zhì)折疊�、糖基化和二硫鍵的形成)��,表達的蛋白質(zhì)與天然蛋白質(zhì)更為接近��,且能通過(guò)控制翻譯后修飾實(shí)現預期功效��。
第二�,長(cháng)效化重組蛋白的進(jìn)展較大����。利用化學(xué)修飾�����、基因工程技術(shù)等對蛋白質(zhì)藥物進(jìn)行改造或修飾�����,解決大分子蛋白質(zhì)藥物血液中半衰期短����、給藥途徑單一�����、免疫原性和毒副反應等問(wèn)題��,增強藥物活性��、提高藥效等��,是近年來(lái)生物技術(shù)藥物發(fā)展的趨勢�。長(cháng)效蛋白質(zhì)生物制劑技術(shù)的研究一直是大分子蛋白質(zhì)藥物的研究熱點(diǎn)�����,國際上許多大公司紛紛開(kāi)展蛋白質(zhì)藥物長(cháng)效制劑的開(kāi)發(fā)研究�,搶占核心技術(shù)的制高點(diǎn)��。
重組蛋白藥物長(cháng)效化技術(shù)常用化學(xué)修飾���、突變體構建�、蛋白融合�����、糖基化等策略�?�;瘜W(xué)修飾如聚乙二醇(polyethyleneglycol��,PEG)修飾����、聚磷酸酯(PPE)修飾��、聚羧基甜菜堿(Poly( carboxybetaine)���,PCB)修飾���、多聚唾液酸(Polysialition�����,PSA)�����、脂肪酸修飾等�����。它們通過(guò)化學(xué)的方法將蛋白質(zhì)藥物與大分子親水修飾劑進(jìn)行共價(jià)偶聯(lián)的方法�。共價(jià)連接到大分子上能減小免疫原性���,改善可溶性和生物學(xué)利用度�,以及增加抗蛋白水解作用��,同時(shí)也能夠延長(cháng)半衰期��。
構建突變體是將蛋白分子一個(gè)位點(diǎn)或多個(gè)位點(diǎn)進(jìn)行突變�����,以期改善蛋白穩定性��,提高親和力或活性�����,降低免疫原性等���,是蛋白藥物設計的一個(gè)重點(diǎn)方向�����。
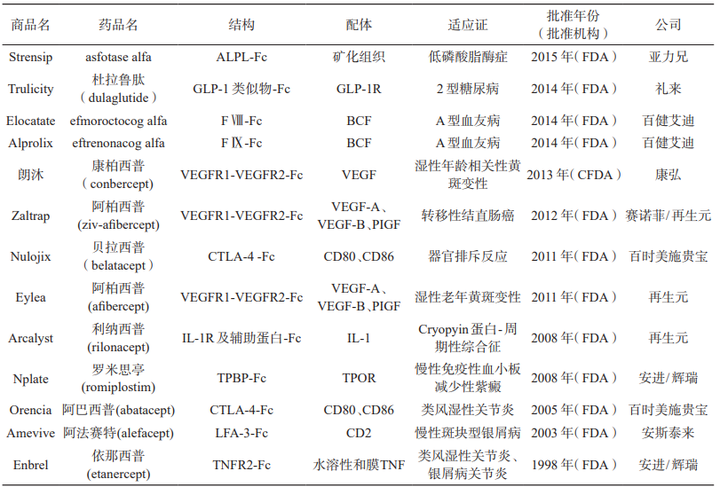
蛋白融合也被認為是天然蛋白修飾��,包括Fc融合蛋白和人血清白蛋白融合蛋白���。Fc融合蛋白是指利用基因工程等技術(shù)將某種具有生物學(xué)活性的功能蛋白分子與Fc片段融合而產(chǎn)生的新型蛋白質(zhì)����,功能蛋白可以是能結合內源性受體(或配體)的可溶性配體(或受體)分子或其他需要延長(cháng)半衰期的活性物質(zhì)(如細胞因子)����。Fc融合蛋白大大增加活性蛋白或多肽的分子量�����,降低腎小球的濾過(guò)率����,而FcRn (Neonatal Fc receptor�����,新生兒Fc受體)介導的再循環(huán)機制可以避免蛋白降解�����,有效延長(cháng)半衰期�����。
Fc融合蛋白的發(fā)展分為兩個(gè)階段:第一階段�,對于小分子肽通過(guò)表達二聚體融合蛋白實(shí)現延長(cháng)藥物的半衰期(例如禮來(lái)糖尿病藥物Trulicity)����;第二階段����,對于分子量大于30 kDa的大分子蛋白使用二聚體Fc和單體蛋白策略�����。作為目前最為成功的蛋白長(cháng)效化手段之一�,目前已有10多種批準上市的Fc融合蛋白藥物���。
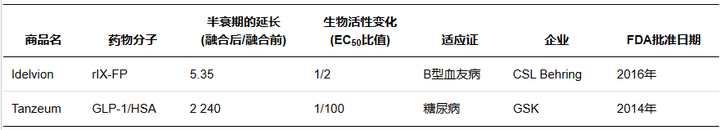
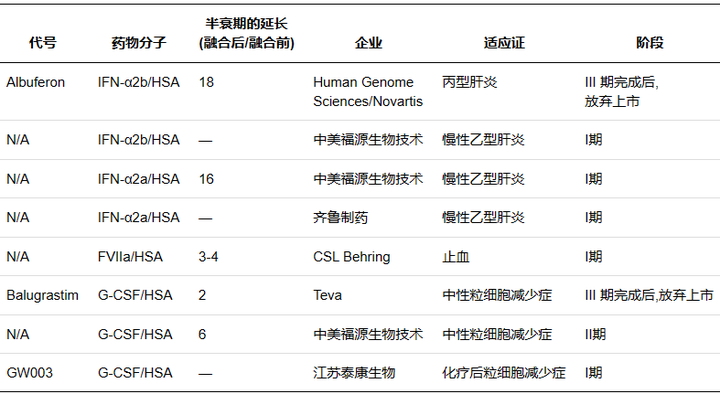
人血清白蛋白( Human serum albumin�,HSA) 是血漿中含量最高的蛋白質(zhì)���,相對分子質(zhì)量66500��,半衰期約19 d���。作為一種長(cháng)效的天然蛋白��,其長(cháng)效機制在于HSA在弱酸性的溶酶體( pH6.0) 環(huán)境中可通過(guò)結構域III結合FcRn���,隨后通過(guò)FcRn的跨膜作用被重新轉運至血液����,并在中性血液中( pH7.4) 被釋放�����,避免了溶酶體的降解作用��。作為天然蛋白�,HAS 還具有親水穩定�、安全無(wú)毒等優(yōu)點(diǎn)�����,藥物可以通過(guò)基因融合或共價(jià)修飾的方式直接結合����,也可以通過(guò)結合 HSA配體與其非共價(jià)結合��,因此 HSA 可作為理想的天然修飾物�����。
Marketed albumin fusion proteins
Albumin fusion proteins in clinical development
蛋白質(zhì)的糖基化(Glycosylation)是真核生物的一種常見(jiàn)翻譯后修飾方式��,是某些蛋白質(zhì)發(fā)揮生物活性所必需的��。蛋白質(zhì)表面的糖鏈能夠影響蛋白質(zhì)的藥物動(dòng)力學(xué)作用���、生物活性��、穩定性����、對蛋白酶的易感性�、水溶性��、凝集性�����、免疫原性等���。因此糖基化修飾也是延長(cháng)半衰期的常用手段��。
具體說(shuō)來(lái)�����,糖基化可分為N-糖基化與O-糖基化��。N-糖基化是指聚糖通過(guò)糖苷酰胺連接在 Asn-X-Ser/Thr共有序列中Asn殘基的側鏈上�,工程上N-糖基化通常通過(guò)引入Asn-X-Ser/Thr序列�,增加N-糖基化位點(diǎn)完成��。O-糖基化則是聚糖通過(guò)O-糖苷鍵連接到Ser側鏈或Thr的羥基上��。
需要說(shuō)明的是���,作為典型的翻譯后修飾手段��,糖基化修飾往往需要通過(guò)工程化哺乳動(dòng)物細胞完成�����,修飾糖的種類(lèi)�����、數量�����、分子大小�、序列和電荷等因素對于藥物理化性質(zhì)和生物活性的影響復雜而特異��,并有助于提高藥物的靶向性�����。然而由于糖基化可控性低�����,因此糖基化藥物在應用上仍面臨著(zhù)產(chǎn)率低���、控制困難等技術(shù)挑戰���。
[1] Haris B,Saraswathi S,Hussain K.Somatostatin analogues for the treatment of hyperinsulinaemic hypoglycaemia[J].Ther Adv Endocrinol Metab,2020,11: 1-23.
[2] Pairawan S,Zhao M,Yuca E,et al.First in class dual MDM2/MDMX inhibitor ALRN-6924 enhances antitumor efficacy of chemotherapy in TP53 wild-type hormone receptor-positive breast cancer models[J].Breast Cancer Res,2021,23( 1) : 23-29.
[3] Zaman R,Islam R,Ibnat N,et al.Current strategies in extending half-lives of therapeutic proteins[J].J Control Release�,2019�,301: 176-189.
[4] Kinstler OB, Gabriel NE, Farrar CE, et al. N-terminally chemically modified protein compositions and methods: US, 7090835. 2006-08-15.
[5] Ilyushin DG, Smirnov IV, Belogurov AA, et al. Chemical polysialylation of human recombinant butyrylcholinesterase delivers a long-acting bioscavenger for nerve agents in vivo. Proc Natl Acad Sci USA, 2013, 110(4): 1243–1248. DOI: 10.1073/pnas.1211118110
[6] Rogers B,Dong D,Li Z.Recombinant human serum albumin fusion proteins and novel applications in drug delivery and therapy.Curr Pharm Des, 2015,21(14):1899-1907.